深度解析:多重免疫荧光(TSA)与IHC/IF的核心差异
在组织原位蛋白检测领域,免疫组化(IHC)、普通免疫荧光(IF)与多重免疫荧光(TSA)是应用最广泛的三大技术。三者均以抗原抗体特异性结合为基础,但在检测通量、灵敏度、空间解析能力上存在本质区别,直接决定了其在科研与临床场景中的适用范围。本文将从技术核心、关键性能、适用场景三大维度,系统拆解三者的差异,为实验设计与技术选型提供精准参考。
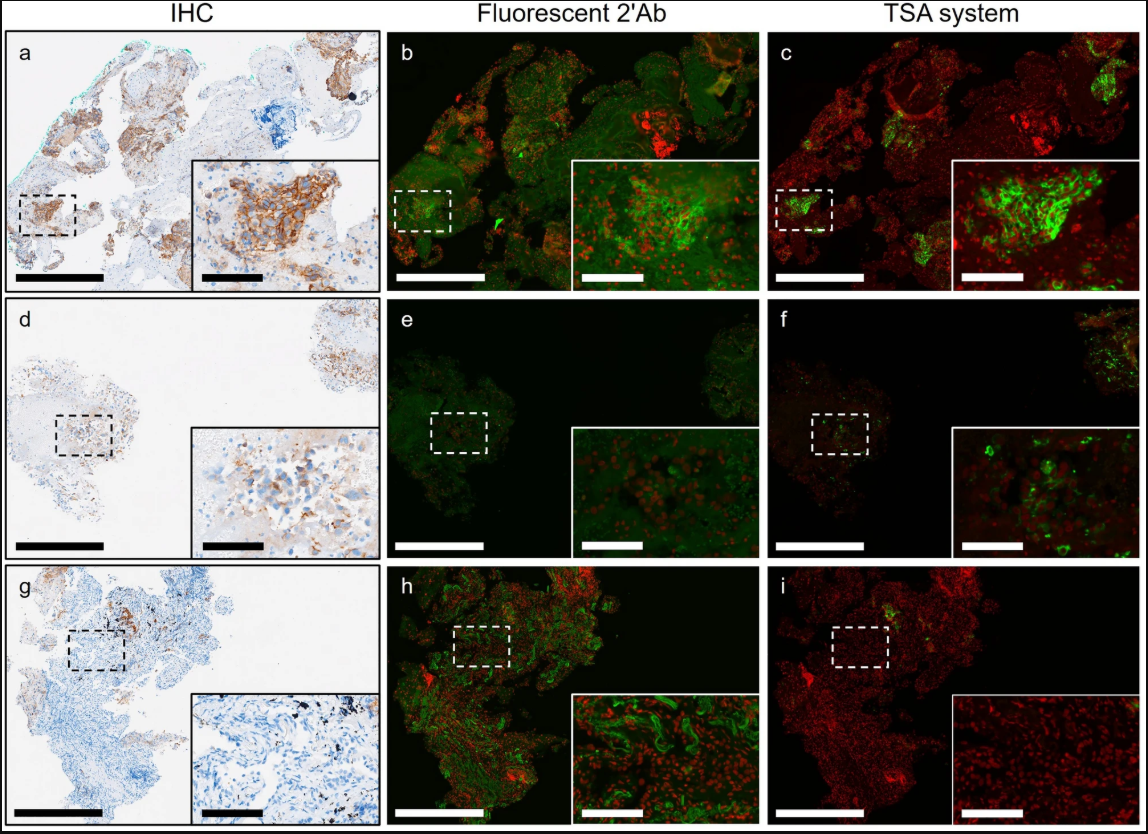
PD-L1在非小细胞肺癌切片IHC、IF、TSA图像中的表达模式[1]
一、技术核心对比
三大技术的核心区别源于“信号生成与放大机制”的不同,这一本质差异直接导致了后续检测能力的分层。
1. 免疫组化(IHC):酶促显色的“单靶标基础工具”
IHC的核心原理是“抗体标记-酶促显色”:一抗结合靶标蛋白后,二抗偶联辣根过氧化物酶(HRP)或碱性磷酸酶(AP),通过酶催化底物(如DAB、AEC)生成不溶性有色沉淀,在光学显微镜下直接观察。其信号生成无需荧光激发,依赖酶与底物的化学反应,且无信号放大机制——信号强度完全依赖靶标蛋白的天然丰度与抗体结合效率。
由于有色沉淀无法被特异性清除,单张切片一次只能检测1个靶标,若需分析多靶标关系,需重复制作多张连续切片,通过图像配准间接关联,易因切片差异导致数据偏差。
2. 普通免疫荧光(IF):荧光直接标记的“有限多靶标工具”
IF将IHC的“酶促显色”替换为“荧光分子直接偶联”:二抗直接连接荧光素(如FITC、Cy3、Cy5),通过特定波长激发光照射产生荧光信号,实现靶标定位。为突破单靶标限制,普通IF可用不同荧光基团标记抗体实现多靶标检测,但受限于两大核心瓶颈:
荧光光谱重叠:不同荧光素的激发/发射光谱易交叉(如FITC与Cy3的光谱重叠率达30%),单张切片最多稳定检测3-4个靶标,超过此数量会出现严重信号串扰。
无信号放大:与IHC类似,IF信号强度依赖靶标丰度,低丰度蛋白(如信号通路激酶、微量肿瘤标志物)易被背景荧光掩盖,检测灵敏度受限。
3. 多重免疫荧光(TSA):信号级联放大的“高通量精准工具”
TSA技术全称为酪胺信号放大(Tyramide Signal Amplification),是在IF基础上引入“酶促信号级联放大+循环标记”的革命性技术。其核心原理分为两步:
信号放大:一抗结合靶标后,二抗偶联HRP,HRP催化带有荧光基团的酪胺分子发生氧化聚合反应,使大量荧光分子共价结合在靶标周围的蛋白质上,形成“靶标-抗体-HRP-荧光聚合物”复合体,信号强度较普通IF提升50-100倍。
循环标记:完成第一轮检测后,通过温和化学方法淬灭HRP活性并剥离一抗、二抗,仅保留共价结合的荧光信号,随后重复“一抗结合-TSA放大”流程,配合不同光谱的荧光素,实现多轮靶标标记。
这种“信号放大+循环标记”的组合,彻底突破了普通IF的靶标数量与灵敏度限制,单张切片可轻松实现5 - 10色甚至更多靶标检测,且低丰度蛋白信号也清晰可辨。
二、关键性能对比
性能维度 | 免疫组化(IHC) | 普通免疫荧光(IF) | 多重免疫荧光(TSA) |
|---|---|---|---|
抗体选择 | 单张切片仅能使用一种一抗 | 不同种属的不同一抗,连接不同荧光基团的不同种属的二抗 | 可选择同一种属的不同一抗配合HRP标记的同一种属的二抗使用 |
检测灵敏度 | 低(无信号放大,仅检出高丰度蛋白) | 中(依赖荧光强度,低丰度易漏检) | 极高(50-100倍信号放大,可检出极低丰度靶标) |
空间分辨率 | 低 | 中 | 高 |
背景噪音 | 中(非特异性酶促反应易产生沉淀) | 高(组织自发荧光+抗体非特异性结合) | 低(信号放大靶向性强,循环淬灭减少残留) |
定量能力 | 定性/半定量 | 半定量 | 精准定量(荧光信号稳定,适配AI图像分析) |
操作难度 | 相对简单、标准化 | 相对简单、标准化 | 步骤多,需精细优化 |
实验成本 | 低 | 一抗二抗需选用不同种属,抗体成本高 混合染色不利于摸索实验条件,容易浪费切片,增加实验成本 | 抗体适用性高,可节省成本 多轮染色实验且抗体可剥离,方便随时调整实验方案 |
核心结论:IHC是“基础定性工具”,IF是“有限多靶标工具”,而TSA是“高通量精准工具”。三者并非替代关系,而是针对不同需求的分层选择——当研究聚焦单一高丰度靶标时,IHC经济高效。当需3个以内靶标共定位时,IF操作简便。当需解析复杂分子网络(如肿瘤微环境多细胞互作)时,TSA是唯一可行技术。
三、适用场景对比
技术性能的差异直接决定了其适用场景:
1. 免疫组化(IHC):临床病理诊断的“标准筛选工具”
IHC的核心优势是操作简便、成本低、结果稳定,且有色沉淀可长期保存,因此成为临床病理诊断的“入门级工具”,主要用于:
肿瘤基础分型:如通过CK(细胞角蛋白)标记上皮源性肿瘤、Vimentin标记间叶源性肿瘤。
单一靶点筛查:如乳腺癌HER-2蛋白表达初筛、肺癌EGFR蛋白表达定性检测。
基础科研快速验证:如验证特定蛋白在组织中的表达部位。
2. 普通免疫荧光(IF):基础科研的“简单多靶标工具”
IF无需酶促反应,可实现靶标的快速定位,且能同时观察2-3个靶标的空间关系,适用于基础科研中“简单分子互作”分析,主要场景包括:
蛋白共定位验证:如通过FITC标记A蛋白、Cy3标记B蛋白,观察二者是否在细胞质中重叠。
细胞亚群初步区分:如在免疫组织中用CD3(T细胞)和CD20(B细胞)双标,观察两类细胞的分布差异。
活细胞动态观察:如标记细胞骨架蛋白(微管、微丝),实时追踪细胞分裂过程中的结构变化。
3. 多重免疫荧光(TSA):复杂系统解析的“核心工具”
TSA的高通量、高灵敏度优势,使其成为解析“复杂分子网络”和“精细空间关系”的核心技术,尤其适用于肿瘤微环境、神经科学等复杂场景,主要应用包括:
肿瘤微环境全景解析:同时标记肿瘤细胞、免疫细胞、免疫检查点及血管,量化各细胞亚群的空间分布与互作关系。
神经科学研究:标记神经元和突触上的多种蛋白标志物,深入研究神经系统的结构和功能。
开发免疫疗法:通过检测免疫细胞表面的多种受体和分子标记,深入研究免疫细胞的分化、功能以及它们之间的相互作用,可以揭示免疫系统的运行机制。
助力空间组学:TSA染料能够提供细胞和组织中分子表达的空间分辨率信息。空间组学结合了基因组学、蛋白质组学和其他组学技术,以保留样本原始空间结构的方式分析生物分子。
AI辅助分析:高分辨率、低背景的多色数据,适配AI算法实现单细胞分割、靶标定量及自动化诊断模型构建。
四、选择建议:三步锁定最优技术方案
结合上述差异,在实际工作中可通过“明确需求-匹配性能-权衡成本”三步法选择技术:
第一步:明确核心需求——判断是单一靶标定性,2-3个靶标共定位还是3个以上靶标网络解析。
第二步:匹配技术性能——高丰度单靶标选IHC,2-3个靶标选普通IF,复杂多靶标或低丰度靶标必选TSA。
第三步:权衡成本与效率——IHC成本最低、周期最短;普通IF成本中等、周期较短;TSA成本较高、周期较长,但数据价值远超成本投入。
Enkilife不仅为客户提供TSA多重标记全套试剂盒,还提供多种TSA特色技术服务,包括IF荧光染色、荧光全景扫描、超多标染色、病理分析(5标及以下)。具体详询 TSA技术服务-EnkiLife
参考文献
1. Huang HN, Kuo CW, Hung YL, Yang CH, Hsieh YH, Lin YC, Chang MD, Lin YY, Ko JC. Optimizing immunofluorescence with high-dynamic-range imaging to enhance PD-L1 expression evaluation for 3D pathology assessment from NSCLC tumor tissue. Sci Rep. 2024 Jul 2;14(1):15176. doi: 10.1038/s41598-024-65187-x. PMID: 38956114; PMCID: PMC11219731.
