文献分享:多重免疫荧光鉴定高间质CD68⁺PD-L1⁺巨噬细胞
背景
近年来,免疫检查点抑制剂联合化疗的方案显著改善了部分三阴性乳腺癌(TNBC)患者预后,但现有生物标志物存在明显不足,商用PD-L1检测试剂盒的抗体克隆号差异导致检测阈值不统一,且仅以“免疫细胞阳性率>1%”作为判断标准,无法区分PD-L1表达的细胞类型,导致患者筛选准确性有限,响应率仅8%-20%。因此,利用多重免疫荧光TSA技术解析PD-L1在不同免疫细胞上的表达特征,成为优化TNBC患者分层与治疗决策的关键方向。
James Wang团队在《scientific reports》上发表了题为 “Multiplexed immunofluorescence identifies high stromal CD68⁺PD-L1⁺ macrophages as a predictor of improved survival in triple negative breast cancer”的研究,研究围绕TNBC中PD-L1表达的细胞特异性展开,利用多重免疫荧光TSA技术,系统鉴定TNBC肿瘤微环境中表达PD-L1的免疫细胞表型,明确不同PD-L1阳性细胞亚群的构成。分析特定PD-L1阳性免疫细胞表型与患者总生存期、乳腺癌特异性生存期的关联。验证CD68⁺PD-L1⁺表型相较于单一PD-L1指标在预后预测中的增量价值,为TNBC患者的风险分层与治疗决策提供新的生物标志物。
TSA多重免疫荧光实验设计
研究采用回顾性队列设计,纳入悉尼圣乔治医院244例TNBC患者的FFPE组织样本,通过组织芯片(TMA)技术构建样本库,每例样本选取肿瘤外周区域的代表性组织芯片,同时纳入正常脾脏、肾脏及乳腺组织作为内参对照。使用基于TSA的Opal 多重染色技术,筛选8种核心标志物构建检测通道,涵盖T细胞(CD3、CD8)、B细胞(CD20)、巨噬细胞(CD68)、免疫检查点分子(PD-1、PD-L1)、调节性T细胞(FOXP3)及肿瘤细胞(Pan-CK,泛细胞角蛋白)。实验流程包括:组织切片脱蜡复水、抗原修复、一抗孵育、HRP标记二抗结合、TSA荧光底物孵育,最后以DAPI进行细胞核复染。图像分析采用开源软件QuPath,结合机器学习算法完成组织分割、细胞识别及表型鉴定,最终实现各免疫表型细胞在基质区域的计数与密度量化,以中位数细胞密度作为高/低表达的分界值。
结果展示
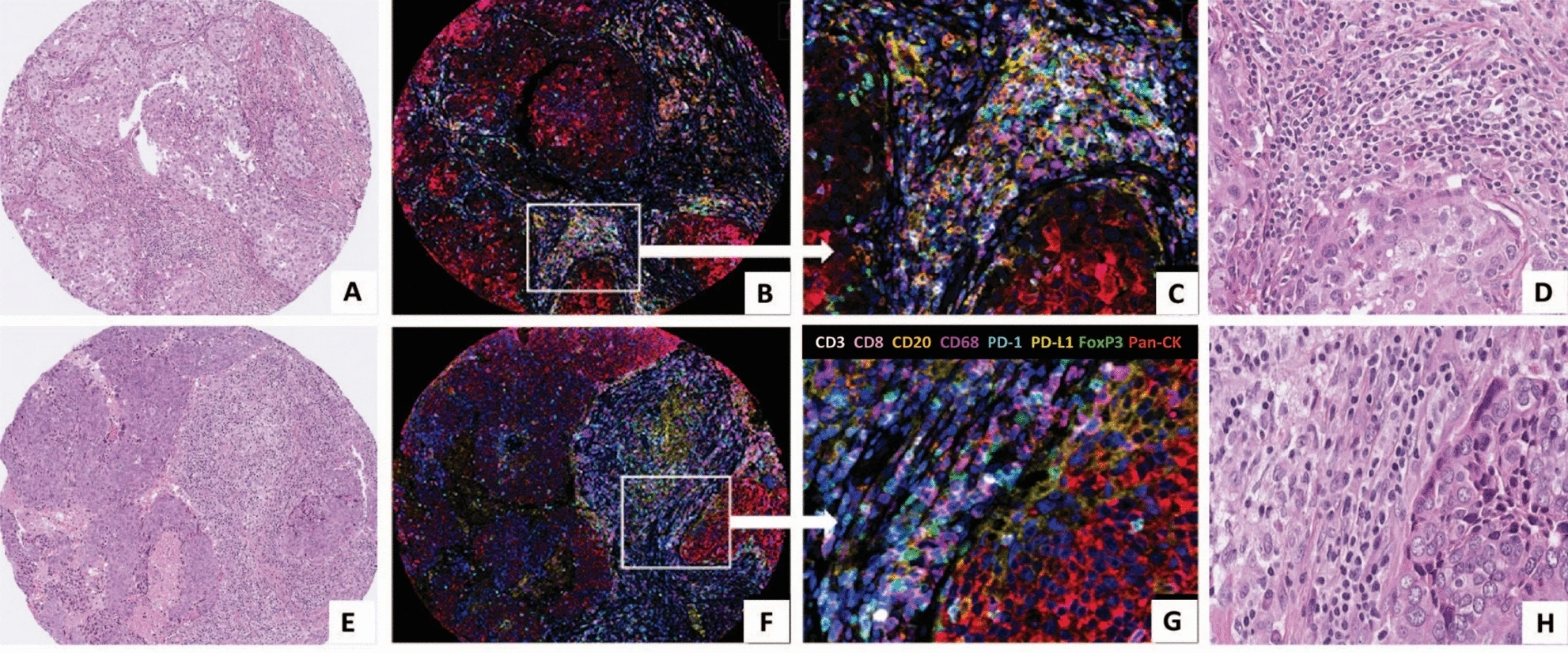
该图包含两名TNBC患者的组织切片图像,H&E染色图像用于展示肿瘤组织的病理形态特征,明确肿瘤细胞与基质区域的分布,为后续多重免疫荧光图像的区域定位提供参照。例如,可观察到肿瘤细胞巢与周围基质中免疫细胞浸润的宏观特征,为解读多重免疫荧光中免疫细胞的分布位置提供病理背景。
多重免疫荧光图像采用8色荧光标记系统。低倍图像可整体观察各免疫细胞在肿瘤基质中的分布模式,高倍图像则清晰呈现不同标志物的共定位情况,例如紫色(CD68)与黄色(PD-L1)信号的重叠区域即为CD68⁺PD-L1⁺巨噬细胞,红色(Pan-CK)信号区域则明确排除肿瘤细胞干扰,确保计数仅针对基质区域免疫细胞。直观验证了TSA技术的有效性,即在同一张切片上实现了8种标志物的清晰区分,无明显光谱干扰。同时通过高倍镜下的信号共定位,证明了CD68⁺PD-L1⁺等复合表型细胞的客观存在。
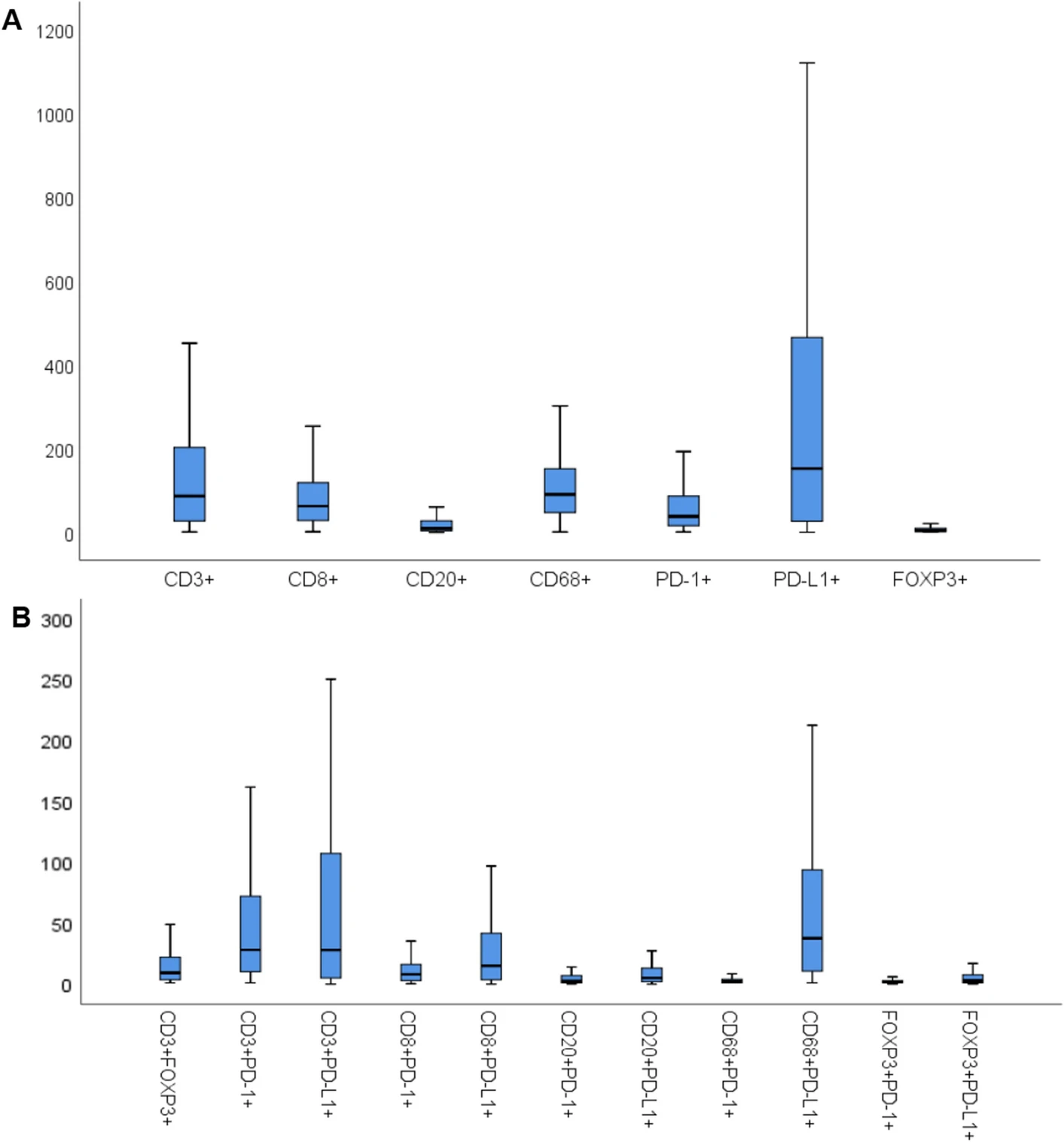
箱线图呈现了不同免疫表型的密度分布,图A聚焦 CD3⁺、CD8⁺等单一标志物阳性细胞,明确各细胞类型的基线数量特征,其中 PD-L1⁺细胞中位数密度最高,FOXP3⁺最低。图 B 扩展到11种双标志物阳性细胞,重点展示CD68⁺PD-L1⁺核心表型的密度,同时以中位数为界确定高 / 低表达分组标准,后续研究中对患者生存的分析,正是基于这一量化分组展开,让表型数据与临床预后分析紧密衔接。
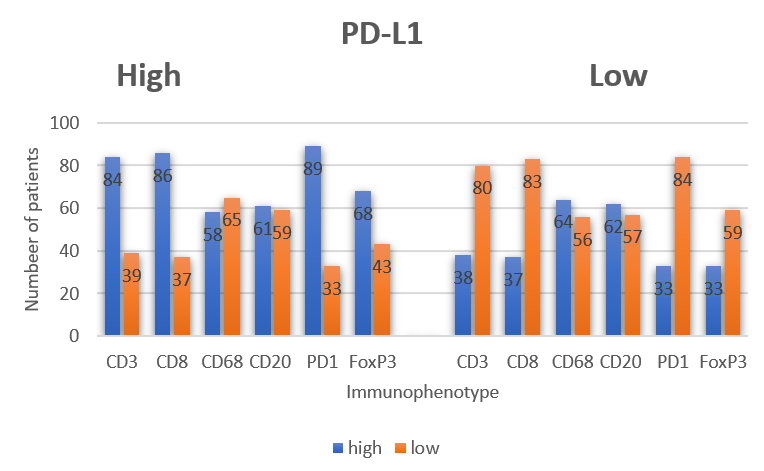
柱状图基于多重免疫荧光染色数据,统计不同免疫表型中 PD-L1⁺细胞的占比,比如 CD68⁺PD-L1⁺占总 CD68⁺细胞的比例、CD3⁺PD-L1⁺占总 CD3⁺细胞的比例。通过占比分析,排除细胞总量差异的干扰,精准识别出 PD-L1 在巨噬细胞中具有较高的共表达比例,这一发现直接将 CD68⁺PD-L1⁺巨噬细胞作为核心研究对象,让表型筛选更具针对性。
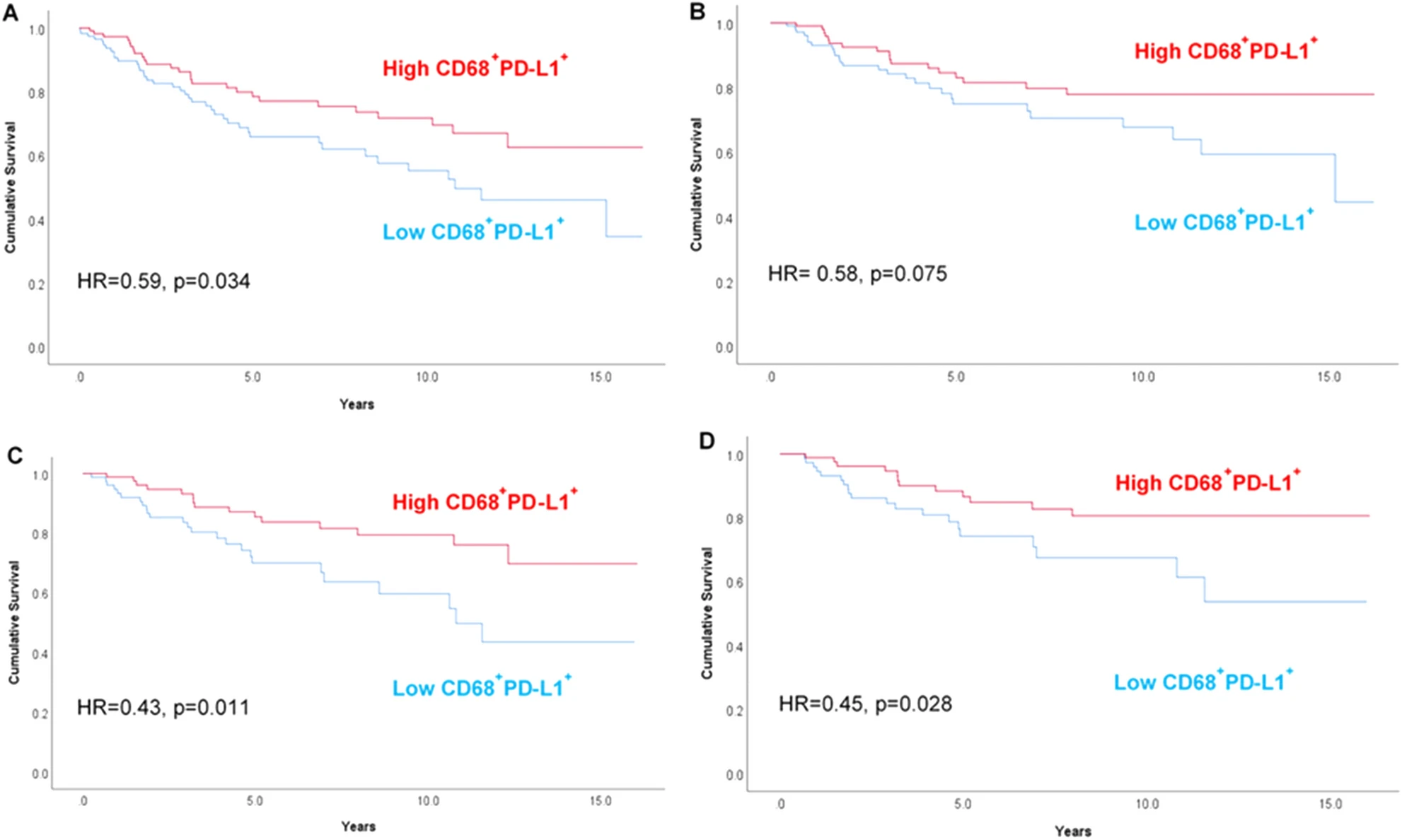
基于TSA多重免疫荧光技术对CD68⁺PD-L1⁺巨噬细胞的精准计数与分层,做Kaplan-Meier 生存曲线,按总体患者-化疗患者及总生存期-乳腺癌特异性生存期分为四个子图,每条曲线均以高CD68⁺PD-L1⁺与低CD68⁺PD-L1⁺分为两组,曲线的分离程度直接反映预后差异。例如,在总体患者的总生存期分析中(图A),高表达组曲线始终位于低表达组上方,且差异具有统计学意义(HR=0.59,p=0.034)。在接受化疗的患者中(图C、D),两组曲线的分离更为明显,证明该表型在化疗人群中的预后预测价值更强。
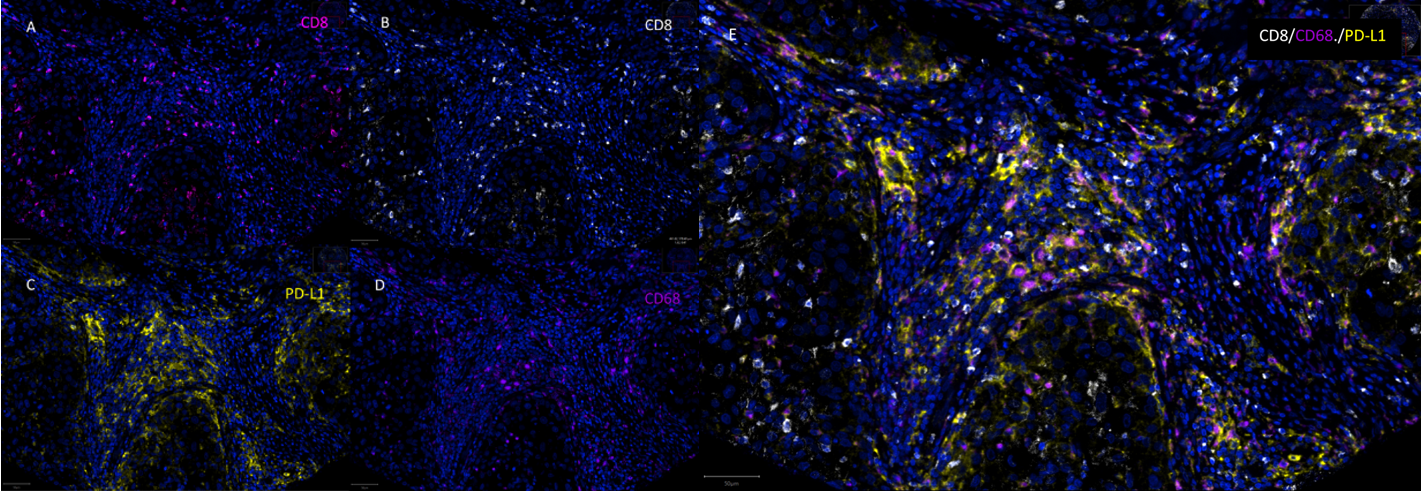
这张图聚焦研究中关键的 CD8、CD68、PD-L1 三种标志物,分别呈现每种标志物的单通道荧光图像与三通道合并图像 。单通道图像可有效排除不同荧光间的光谱重叠干扰,确保信号特异性。合并图像则能清晰展示 CD8⁺PD-L1⁺、CD68⁺PD-L1⁺的共定位细节,尤其明确 CD68 与 PD-L1 的信号重叠区域,进一步验证了多重免疫荧光信号的准确性,为核心表型的鉴定提供了更细致的图像佐证。
总结
本研究以TSA技术为核心的多重免疫荧光方法,成功揭示了CD68⁺PD-L1⁺巨噬细胞在TNBC中的预后价值,为该疾病的精准诊疗提供了新方向。该研究充分体现了TSA技术的核心优势:通过多标志物共定位实现免疫细胞表型的精细解析,解决了传统IHC无法应对的复杂微环境研究需求。同时,研究也为TSA技术的临床应用提供了参考范式——从抗体组合优化、标准化染色流程到定量分析方法,均为后续研究提供了可复现的技术方案。未来,随着TSA技术与人工智能图像分析的深度结合,其在肿瘤免疫分型、治疗响应预测等领域的应用将更加广泛。
参考文献
Wang J, Browne L, Slapetova I, Shang F, Lee K, Lynch J, Beretov J, Whan R, Graham PH, Millar EKA. Multiplexed immunofluorescence identifies high stromal CD68+PD-L1+ macrophages as a predictor of improved survival in triple negative breast cancer. Sci Rep. 2021 Nov 3;11(1):21608. doi: 10.1038/s41598-021-01116-6. PMID: 34732817; PMCID: PMC8566595.
Enkilife mIF 技术服务
提供有偿代检和分析服务
承接多色配套服务
分类 | 服务项目 | 备注 |
|---|---|---|
IHC染色 | IHC单色标记 | |
IF荧光染色 | 免疫荧光单标 | 不含一抗,含二抗(兔/小鼠/大鼠)、DAPI。 四标以上染色需要提供多余白片做单标预实验。 |
荧光多标染色 | ||
全景扫描 | 免疫组化全景扫描 | 提供读片软件及原始相关文件,荧光扫描波长范围。 |
荧光标记全景扫描 | ||
数据分析 | 免疫组化及免疫荧光切片分析 | 可进行全片单阳性、多阳性细胞数及面积分析,也可定制分析特征病理区域,或进行空间分析、位置分析等。 |
