文献分享:基于 TSA 信号放大技术对肺结核病变进行多重荧光染色
背景
结核分枝杆菌(Mycobacterium tuberculosis, Mtb)是专一性人类病原体,通过气溶胶传播进入肺泡后,会诱导驻留肺泡巨噬细胞和募集的髓系细胞形成原发性病变,进而发展为具有中央坏死特征的肉芽肿——这是结核病的典型病理标志。Mtb可在肉芽肿内逃避宿主免疫监视,耐受缺氧、低pH和营养匮乏等应激环境存活,因此深入解析病变组织的空间结构、免疫细胞亚群分布及细菌定植特征,对揭示结核病发病机制、评估干预措施有效性至关重要。
传统研究存在两大技术瓶颈:一是常规免疫荧光技术信号灵敏度低、背景噪声高,难以检测低表达抗原;二是多重标记时,不同物种来源抗体的限制导致标记数量有限,且薄组织切片无法实现3D空间结构的完整表征。此外,肺上皮和间充质谱系的结构细胞在Mtb易感微环境形成中的作用尚未被充分阐明,亟需可同时保留组织完整性、内源性荧光报告信号和核染色的高灵敏度成像技术。Lata S等人的研究《Protocol for 3D multiplexed fluorescent imaging of pulmonary TB lesions using Opal-TSA dyes for signal amplification》中建立的优化方案,正是针对上述需求,实现了厚组织切片中多蛋白标记的精准检测与3D重建。
核心方法

TSA技术的核心原理是辣根过氧化物酶(HRP)标记的二抗在过氧化氢存在下,催化荧光标记的酪酰胺转化为活性形式,后者共价结合于靶抗原附近的酪氨酸残基,实现信号的级联放大。研究选用Opal荧光染料作为标记物,相比传统荧光二抗,其信号灵敏度显著提升,且可在低激光功率下成像,减少组织光漂白。
实验周期约3天,核心流程为以Mtb感染的B6.Sst1S小鼠为模型经灌注固定获取肺组织,后续依次完成4%琼脂包埋与振动切片,通过热诱导或Triton X-100处理进行抗原修复并经过氧化氢和抗体稀释液封闭非特异性位点,再经一抗孵育、HRP标记二抗孵育、Opal染料孵育、抗体剥离及洗涤的循环流程完成多重标记后进行核染色,最后使用与免疫染色所用 Opal 染料相匹配的激发和发射光线,通过共聚焦显微镜采集图像并利用Imaris 10.1.0软件完成3D重建。
关键结果
1. 提升信号灵敏度与特异性,降低背景噪声
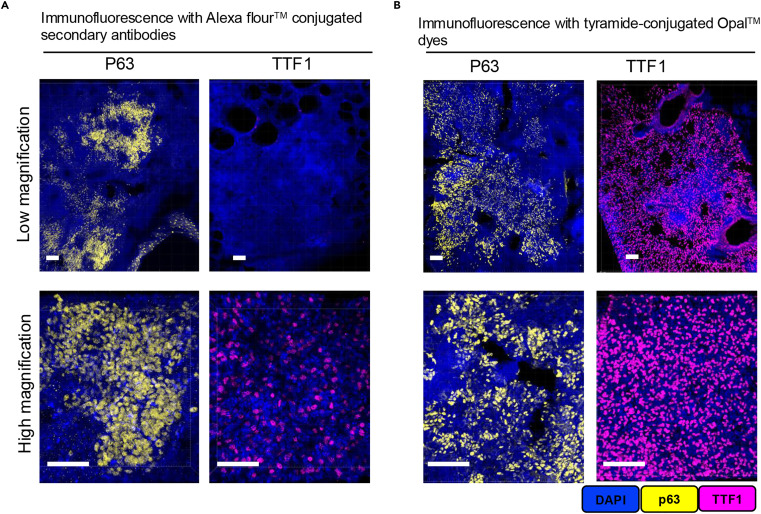
与传统二抗偶联荧光团的免疫荧光技术相比,Opal-TSA技术的信号灵敏度显著提升。左侧为传统Alexa Fluor 488标记低表达抗原TTF1的成像结果,右侧为Opal 570标记同一抗原的成像结果,二者均采用10×物镜拍摄、相同曝光参数。从图中可清晰观察到,左侧传统技术组仅能捕捉到微弱的弥散荧光,无法明确定位抗原表达部位;右侧Opal-TSA组则呈现出明亮、集中的荧光信号,可精准识别TTF1阳性细胞的分布轮廓。
2. 实现同一物种抗体的多重标记,突破标记数量限制
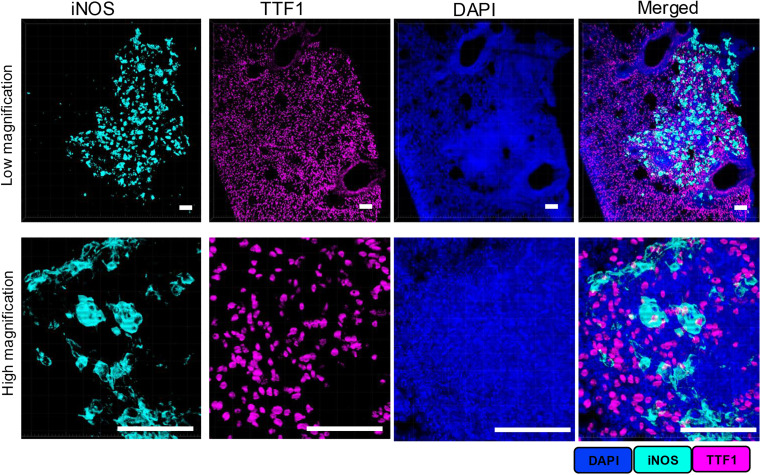
首先聚焦同一物种抗体的双重标记可行性,以 50μm 厚肺结核病变肺组织切片为样本,通过 “染色 - 剥离 - 再染色” 流程完成验证。用兔源 iNOS 特异性一抗染色,经 HRP 标记二抗与 Opal 690 染料显色;再用 BME/SDS 温和剥离缓冲液去除一抗 / 二抗复合物后,加入另一兔源 TTF1 特异性一抗,搭配 HRP 二抗与 Opal 570 染料二次染色。低倍镜和高倍镜下的单通道与合并图像均显示,iNOS 与 TTF1 的荧光信号边界清晰、无通道渗漏,证明温和剥离方案可彻底去除前一轮抗体复合物,且不影响已共价结合的 Opal 染料信号,直接验证了同一物种抗体双重标记的特异性与可靠性。
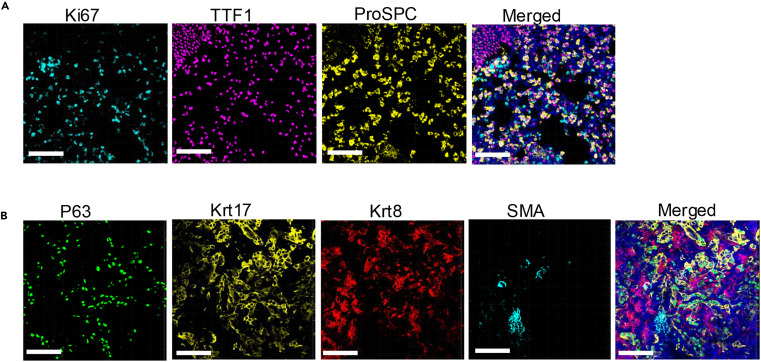
进一步拓展至 3 重、4 重标记,所有一抗均为兔源,通过不同光谱的 Opal 染料区分靶标。三种荧光信号分别定位于病变组织的不同细胞群体,无重叠干扰;四种信号精准对应不同细胞类型的表达特征,合并图像中各靶标分布清晰可辨。两组图像均证明,本方案通过优化的剥离与染色循环,可实现至少 4 种同一物种抗体的多重标记,解决了传统技术中 “抗体来源限制标记数量” 的关键瓶颈,为复杂病变组织中多蛋白共定位分析提供了高效工具。
3. 保留组织完整性与内源性信号,支持3D空间结构解析
优化的样本制备和处理流程可完整保留组织完整性、内源性荧光报告信号和核染色,支持3D空间结构解析。
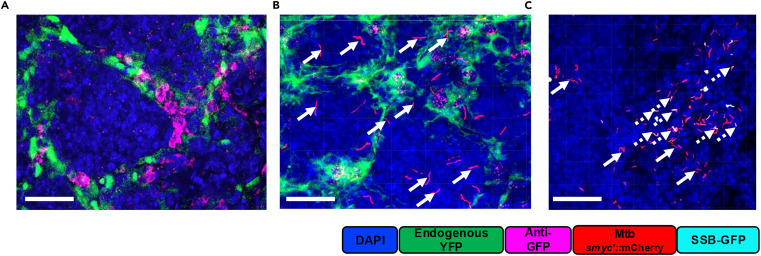
上图聚焦内源性荧光报告系统与 Opal-TSA 多重免疫荧光成像的兼容性,以抗 GFP 抗体染色,结果显示内源性 YFP 报告信号与抗体染色信号完全共定位,证明方案可保留内源性荧光蛋白活性且不干扰抗体检测。抗 TTF1 抗体与细菌报告信号、YFP 信号的合并成像,清晰呈现免疫细胞、细菌与肺上皮细胞的空间分布关系。以无 IFNβ-YFP 报告基因的 B6.Sst1S 小鼠为阴性对照,仅检测到细菌的双荧光信号,无 YFP 非特异性荧光,验证了内源性信号的特异性。
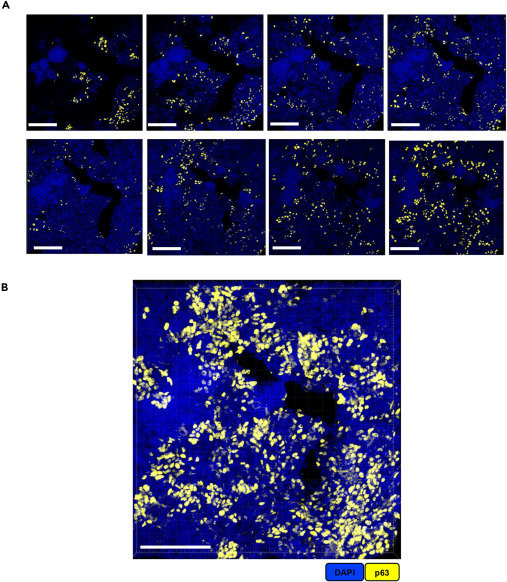
以 50μm 厚肺结核病变肺组织切片为样本,通过 p63 抗体标记靶标,呈现了 2D 共聚焦图像与 3D 重建图像的对比,其中图A为平面 2D 图像,仅能展示靶标在单一平面的分布特征,B为基于该切片 Z-stack 序列经 Imaris 10.1.0 软件重建的 3D 图像,直观呈现了 p63 阳性细胞在病变组织中的三维聚集形态,通过两种成像模式的直接对比,凸显了厚组织切片结合 3D 重建技术的优势,相比 2D 平面成像能更全面、立体地反映病变组织的空间异质性。
4. 传统热诱导抗原修复的替代方法
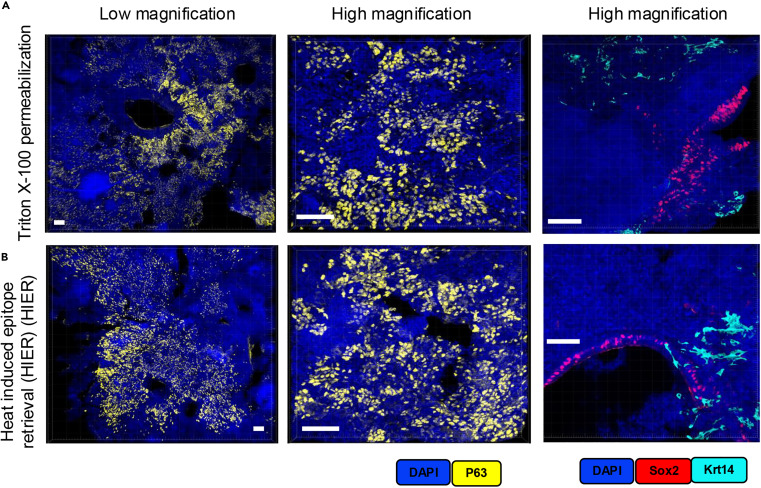
以 50μm 厚肺结核病变肺组织切片为样本,对比了 2% Triton X-100 室温孵育 1 小时的细胞透化方案与传统热诱导抗原修复(HIER,Tris / 硼酸盐 / EDTA 缓冲液 95℃孵育 30 分钟)方案,通过低倍镜、高倍镜下的 p63 单标成像及 Sox2 与 Krt14 双重标记验证,显示两组均能实现抗原的精准定位与特异性检测,且 Triton X-100 组不仅适配多重标记流程,还可避免 HIER 高温导致的组织脆弱、皱缩问题,证明该温和通透化方案能达到与传统 HIER 相当的检测效果,同时更好保护厚组织完整性,为厚组织切片免疫染色提供了更实用的替代选择。
总结
本文通过系统优化Opal-TSA技术,建立了适用于Mtb感染小鼠厚肺组织切片的3D多重荧光成像方案,核心优势在于高信号灵敏度、同一物种抗体的多重标记能力、组织完整性与内源性信号保留,以及清晰的3D空间结构解析。该方案可精准解析PTB病变中免疫细胞与结构细胞的空间分布关系,以及Mtb在病变中的存活与复制状态,为阐明肺结构细胞在Mtb易感微环境形成中的作用、揭示结核病进展的分子机制提供了关键技术工具。同时,方案的高灵敏度可快速筛选感兴趣区域,提升后续高分辨率成像的效率,加速干预靶点的发现。该技术不仅解决了PTB病变解析的关键技术瓶颈,也为其他疾病的组织空间表征提供了重要参考。
参考文献
Lata S, Yabaji SM, O'Connell AK, Gertje HP, Kirber MT, Crossland NA, Kramnik I. Protocol for 3D multiplexed fluorescent imaging of pulmonary TB lesions using Opal-TSA dyes for signal amplification. STAR Protoc. 2025 Mar 21;6(1):103640. doi: 10.1016/j.xpro.2025.103640. Epub 2025 Feb 20. PMID: 39982826; PMCID: PMC11889971.
Enkilife mIF 技术服务
提供有偿代检和分析服务
承接多色配套服务
分类 | 服务项目 | 备注 |
|---|---|---|
IHC染色 | IHC单色标记 | |
IF荧光染色 | 免疫荧光单标 | 不含一抗,含二抗(兔/小鼠/大鼠)、DAPI。 四标以上染色需要提供多余白片做单标预实验。 |
荧光多标染色 | ||
全景扫描 | 免疫组化全景扫描 | 提供读片软件及原始相关文件,荧光扫描波长范围。 |
荧光标记全景扫描 | ||
数据分析 | 免疫组化及免疫荧光切片分析 | 可进行全片单阳性、多阳性细胞数及面积分析,也可定制分析特征病理区域,或进行空间分析、位置分析等。 |
